Pembahasan Soal OSN Kimia 2016 Tingkat Kabupaten (OSK) PDF
Olimpiade Sains Nasional Tingkat Kabupaten / Kota

Pembahasan Soal OSN Kimia 2016 Tingkat Kabupaten (OSK) PDF
Soal OSK Kimia 2016 PDF Nomer 16
Untuk reaksi berikut ini:
2 P(s) + 3 Cl2(g) → 2 PCl3(g) DH = -574 kJ
Berapa mol fosfor yang dibutuhkan untuk menghasilkan panas sebanyak 488 kJ?
A. 0,85 mol P
B. 1,20 mol P
C. 1,70 mol P
D. 2,35 mol P
E. 3,40 mol P
Pembahasan Soal OSK Kimia 2016 PDF Nomer 16
2 mol P akan menghasilkan energi sebesar 574 kJ
x mol P akan menghasilkan energi sebesar 488 kJ
2 mol : x mol = 574 kJ : 488 kJ
x = (2 mol × 488 kJ) : 574 kJ
x = 1,70 mol
Jadi, kunci jawaban Soal OSK Kimia 2016 PDF Nomer 16 adalah C
Soal OSK Kimia 2016 PDF Nomer 17
Perhatikan proses reaksi berikut ini:
2A→ ½B + C ΔH = 5 kJ/mol
3/2B + 4C → 2A + C + 3D ΔH = -15 kJ/mol
E + 4A → C ΔH = 10 kJ/mol
Hitunglah ΔH untuk reaksi : C → E + 3D
A. 0 kJ/mol
B. -20 kJ/mol
C. 10 kJ/mol
D. 20 kJ/mol
E. -10 kJ/mol
Pembahasan Soal OSK Kimia 2016 PDF Nomer 17
Pastikan zat yang bersesuaian ada pada ruas yang sama sesuai dengan reaksi yang akan ditentukan nilai ∆H-nya.
Jumlah reaksi harus menghasilkan persamaan sebagaimana ditentukan, yaitu C → E + 3D
C harus di ruas kiri, E dan D harus ada di ruas kanan.
Membalik persamaan berarti mengalikan tanda ∆H dengan -1.
Jadi, kunci jawaban Soal OSK Kimia 2016 PDF Nomer 17 adalah E
Soal OSK Kimia 2016 PDF Nomer 18
Zat R dapat bereaksi membentuk produk P1 atau produk P2. Profil reaksi untuk dua reaksi tersebut ditunjukkan di bawah ini: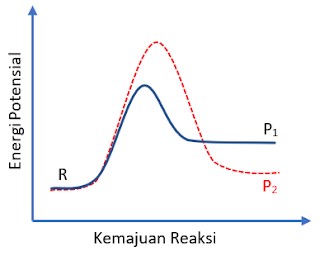
Dibandingkan dengan reaksi R → P1, reaksi R → P2 adalah:
A. Lebih cepat dan kurang endotermis
B. Lebih cepat dan sangat eksotermis
C. Lebih cepat dan lebih endotermis
D. Lebih lambat dan kurang endotermis
E. Lebih lambat dan lebih endotermis
Pembahasan Soal OSK Kimia 2016 PDF Nomer 18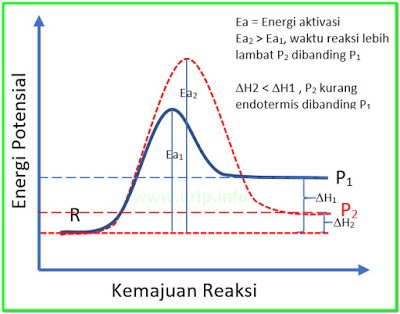
Jadi, kunci jawaban Soal OSK Kimia 2016 PDF Nomer 18 adalah D
Soal OSK Kimia 2016 PDF Nomer 19
Dalam larutan aqueous, ion peroksidisulfat (S2O8–2) bereaksi dengan ion iodida sesuai reaksi berikut ini:
S2O8–2 (aq) + 3I– → 2SO4–2 (aq) + I3– (aq)
Suatu larutan yang disiapkan dengan komposisi 0,050 M ion S2O8–2 dan 0,072 M ion I–, dan kemajuan reaksi diamati dengan mengukur [I–]. Diperoleh data seperti pada Tabel berikut: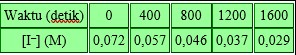
Konsentrasi S2O8–2 yang tersisa pada saat 800 detik adalah
A. 0,015 M
B. 0,041 M
C. 0,076 M
D. 0,004 M
E. 0,046 M
Pembahasan Soal OSK Kimia 2016 PDF Nomer 19
S2O8–2 (aq) + 3I– → 2SO4–2 (aq) + I3– (aq)
Secara stoikiometri 1 mol S2O8–2 yang bereaksi setara dengan 3 mol I–, dan karena volume dalam sistem sama maka dapat dinyatakan sebagai [S2O8–2] = 3 [I–] atau [I–] = ⅓ [S2O8–2]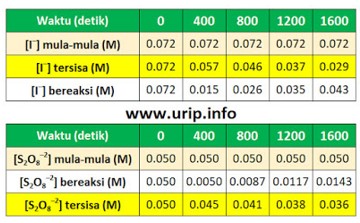
Setelah 800 detik (seperti pada tabel), I– yang tersisa adalah 0,046 M, ini berarti I– yang bereaksi adalah 0,026 M (didapat dari 0,072 M – 0,046 M).
Dengan demikian S2O8–2 yang bereaksi adalah sebanyak 1/3 × 0,026 M atau 0,00867 M.
Jadi S2O8–2 yang tersisa = (0,050 – 0,0087) M = 0,0413 M
Jadi, kunci jawaban Soal OSK Kimia 2016 PDF Nomer 19 adalah B
Soal OSK Kimia 2016 PDF Nomer 20
Dua gas diatom, X2 dan Y2 bereaksi sesuai persamaan berikut :
X2(g) + Y2(g) → 2XY(g).
Suatu campuran X2 dan Y2 masing-masing mengandung 0,5 mol dan dipanaskan dalam wadah tertutup hingga reaksi mencapai kesetimbangan. Grafik berikut ini menunjukkan hubungan antara jumlah mol masing-masing gas dan perubahan waktu.
Berdasarkan grafik di atas, berapa nilai konstanta kesetimbangan, Kc, untuk reaksi ini?
A. 1,5
B. 3
C. 9
D. 12
E. 18
Pembahasan Soal OSK Kimia 2016 PDF Nomer 20
Grafik di atas dapat pula diterjemahkan seperti tabel berikut: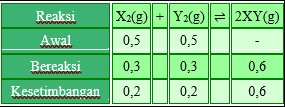
Kc = (0,6/V)2 : 0,2/V × 0,2/V
Kc = 0,36 : 0,4
Kc = 9
Jadi, kunci jawaban Soal OSK Kimia 2016 PDF Nomer 20 adalah C

Satu komentar