Bocoran Soal USBN Kimia 2017 Kurikulum 2013

Bocoran Soal USBN Kimia 2017 Kurikulum 2013 – Tanggal 20 Maret 2017 hingga 4 hari ke depan, semua murid kelas XII SMA melaksanakan USBN 2017 untuk pertama kalinya. Ujian Sekolah Berstandar Nasional ini merupakan kebijakan oleh Menteri Pendidikan yang baru. Sebelumnya sudah saya sampaikan Kisi-kisi USBN 2017 Semua Mata Pelajaran mulai dari SMP SMA SMK dan lain-lain, dapat di download disini. Ok, sebagai persiapan murid-murid terutama murid IPA / MIA, saya lampirkan Bocoran Soal USBN Kimia 2017 K13. Walaupun “BOCORAN” sebenarnya soal ini dibuat sesuai kisi-kisi untuk bahan belajar.
Bocoran Soal USBN Kimia 2017 Kurikulum 2013
INFO UPDATE : SOAL USBN TAHUN 2019 SEMUA MAPEL klik disini
Baca juga:
- Download Soal dan Pembahasan UN Kimia Paket 1
- Pembahasan Soal UNBK Kimia Tahun 2018 Paket 2
- Hari Libur Nasional dan Cuti Bersama Tahun 2019
- Soal Essay dan Pembahasan Pergeseran Kesetimbangan Kimia
- Soal dan Pembahasan Gaya Antarmolekul
1. Berikut gambar struktur elektron 2 buah ion Q dan R:
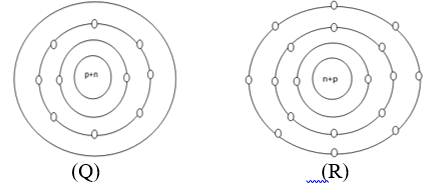
Pasangan data yang berisi notasi konfigurasi elektron dan letak dalam sistem periodik yang benar untuk unsur Q yang jumlah neutron nya 12 adalah….
| Notasi | Konfigurasi Atom | Periode dan golongan | |
| A. | Q | 1s22s22p63s2 | 3 dan IIA |
| B. | Q | 1s22s22p6 | 3 dan IIA |
| C. | Q | 1s22s22p63s23p5 | 3 dan VIIA |
| D. | Q | 1s22s22p63s23p6 | 3 dan VIIIA |
| E. | Q | 1s22s22p6 | 3 dan VIIA |
2. Berikut gambar percobaan Rutherford:
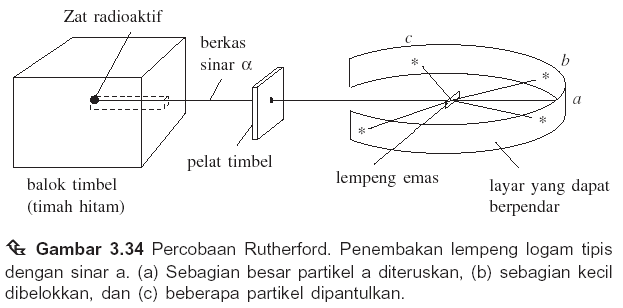
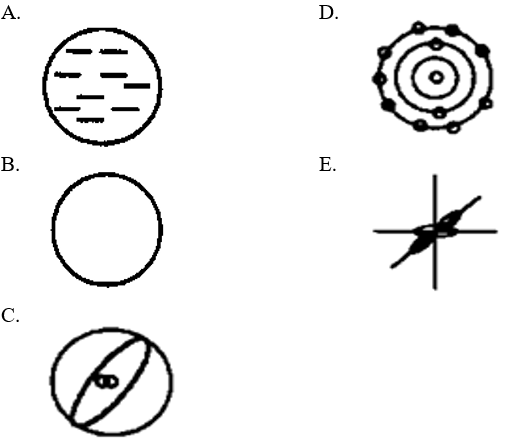
Kesimpulan hasil percobaan berikut gambar model atomnya yang paling tepat adalah….
3. Berikut konfigurasi elektron 2 buah unsur X dan Y:
X: 1s22s22p2
Y: 1s22s22p63s23p5
Rumus senyawa yang terbentuk, jenis ikatan dan sifatnya adalah ….
A. XY4,ion, non polar
B. XY4, kovalen, non polar
C. XY3, kovalen, polar
D. XY2, kovalen, non polar
E. XY , kovalen, polar
4. Berikut data titik didih beberapa senyawa hidrida segolongan (VA,VIA,VIIA):
| Golongan VA | Golongan VIA | Golongan VIIA | |||
| NH3 | -33 | H2O | +100 | HF | +20 |
| PH3 | -87 | H2S | -61 | HCl | -85 |
| A2H3 | -55 | H2Sl | -41 | HBr | -67 |
| S6H3 | -18 | H2Tl | -2 | HI | -35 |
Perbedaan titik didik pada senyawa senyawa tersebut disebabkan karena adanya….
A. Ikatan kovalen
B. Ikatan ion
C. Ikatan hidrogen
D. Ikatan van der waals
E. Ikatan lkovaln koordinat
5. Berikut notasi 2 unsur: P nomor atom 15 dan Cl nomor atom 17
Jumlah pasang elektron bebas dan terikat serta bentuk molekul senyawa yang terjadi jika kedua unsur tersebut berikatan secara oktet adalah….
| Jumlah pasang
elektron bebas |
Jumlah pasang
elektron terikat |
Bentuk molekul | |
| A. | 1 | 3 | Piramida |
| B. | 0 | 5 | Piramida |
| C. | 2 | 2 | Linier |
| D. | 0 | 4 | Tetra hedral |
| E. | 0 | 3 | Segitiga samasisi |
Lanjut halaman 2

Satu komentar