Pembahasan Soal KSN-K Kimia 2020 PDF Pilgan Nomor 1-15
Link download soal dan pembahasan pilgan KSN-K 2020 tingkat Kabupaten/Kota

Download Pembahasan Soal KSN-K Kimia 2020 PDF Tingkat Kabupaten/Kota Pilgan Nomor 1-15 – Pelaksanaan Kompetisi Sains Nasional Tingkat Kabupaten/Kota tahun 2020 atau KSN-K 2020 sudah usai. Saatnya kita membahas soal KSN-K Kimia 2020 sebagai bahan persiapan KSN-K 2021 2022 atau persiapan KSN-P 2020 atau seleksi KSN tingkat Provinsi 2020.
Download Pembahasan Soal KSN-K Kimia 2020 PDF Tingkat Kabupaten/Kota Pilgan Nomor 1-15
Pembahasan Soal Kimia Pilgan KSN-K 2020 Nomor 1-15 (Download)
Pembahasan Soal Kimia Pilgan KSN-K 2020 Nomor 16-20 (Download)
Kumpulan soal dan kunci jawaban KSN-K 2020 semua bidang lomba (Download)
Soal KSN-K 2020 Kimia Nomor 1
Dalam suasana basa, logam kobalt (Co) dapat mengalami reaksi oksidasi menjadi Co(OH)3 sementara natrium hipoklorit, NaOCl, dapat direduksi menjadi NaCl. Apabila reaksi tersebut disetarakan maka koefisien reaksi kobalt dan NaOCl masing-masing adalah …..
A. 2 dan 3
B. 1 dan 3
C. 3 dan 2
D. 1 dan 2
E. 3 dan 1
Pembahasan Soal KSN-K 2020 Kimia Nomor 1
Reaksi Oksidasi:
2Co + 6OH– → 2Co(OH)3 + 6e–
Reaksi Reduksi:
3NaOCl + 3H2O + 6e– → 3NaCl + 6OH–
Reaksi redoks:
2Co + 3NaOCl + 3H2O → 2Co(OH)2 + 3NaCl
Kunci Jawaban Soal KSN-K 2020 Kimia: A
Soal KSN-K 2020 Kimia Nomor 2
Massa CaCl2 yang dibutuhkan untuk membuat 500 mL larutan CaCl2 yang konsentrasinya 0,200 M adalah …..
A. 0,100 g
B. 0,200 g
C. 5,550 g
D. 11,100 g
E. 22,20 g
Pembahasan Soal KSN-K 2020 Kimia Nomor 2
[CaCl2] = 0,2 M atau 0,2 mol/L; V(CaCl2) = 0,5 Ln(CaCl2) = [CaCl2] × V(CaCl2)
n(CaCl2) = 0,2 mol/L × 0,5 L
n(CaCl2) = 0,1 mol
Sehingga, m(CaCl2) = n(CaCl2) × M(CaCl2)
m(CaCl2) = 0,1 mol × (40,08 + 35,45×2) g/mol
m(CaCl2) = 11,098 g
Kunci Jawaban Soal KSN-K 2020 Kimia: D
Soal KSN-K 2020 Kimia Nomor 3
Di antara kelompok senyawa berikut ini, yang merupakan senyawa ionik adalah …..
A. N2O4 , NH3, NH4Cl
B. NH4Cl, NaCl, Na2O2
C. NF3, (NH4)2SO4 , PCl3
D. AsH3, AlCl3, PCl3
E. NCl3, NaCl, CaC2
Pembahasan Soal KSN-K 2020 Kimia Nomor 3
Pengertian senyawa ionik adalah senyawa yang tersusun antara ion positif (kation) dan ion negatif (anion). Biasanya senyawa ionik tersusun antara unsur logam dan nonlogam, kecuali kation NH4+ dalam NH4Cl tersusun dari unsur nonlogam namun bermuatan positif.
Kunci Jawaban Soal KSN-K 2020 Kimia: B
Soal KSN-K 2020 Kimia Nomor 4
Asam sulfat, H2SO4 , dibuat dengan mereaksikan 400 g SO2, 175 g O2 , dan 125 g H2O. Reaksi berlangsung menurut persamaan reaksi (belum setara)
SO2 + O2 + H2O → H2SO4
Pernyataan yang tidak benar adalah …..
A. Jika reaksi berlangsung sempurna, maka 6,25 mol SO2 berubah menjadi 612,5 g H2SO4
B. SO2 merupakan pereaksi pembatas
C. Air terdapat dalam jumlah berlebih
D. Pada proses ini dihasilkan 700 g H2SO4
E. Pada akhir reaksi terdapat sisa oksigen 75 g
Pembahasan Soal KSN-K 2020 Kimia Nomor 4
Menguji kebenaran setiap pernyataan:
A. Reaksi sempurna menghasilkan 6,25 mol H2SO4 atau setara dengan massa = 6,25 mol × 98 g/mol = 612,5 g. → benar
B. SO2 dalam reaksi memang habis bereaksi dan ia merupakan pereaksi pembatas (jumlahnya terbatas) → benar
C. Air dalam reaksi memang berlebih sebanyak 0,69 mol → benar
D. Pada proses ini H2SO4 yang dihasilkan 612,5 g, bukan 700 g → tidak benar
E. Sisa oksigen 2,344 mol atau setara dengan massa = 2,344 mol × 32 g/mol = 75,008 g → benar
Kunci Jawaban Soal KSN-K 2020 Kimia: D
Soal KSN-K 2020 Kimia Nomor 5
Bila nilai ∆Ho untuk reaksi: Mg(s) + Cl2 (g) → 2MgCl2 (s) adalah –1283,6 kJ, maka entalpi pembentukan standar, ∆Hfo , magnesium klorida adalah …..
A. 0 kJ/mol
B. –321 kJ/mol
C. –641,8 kJ/mol
D. 1283,6 kJ/mol
E. –1283,6 kJ/mol
Pembahasan Soal KSN-K 2020 Kimia Nomor 5
∆Hfo adalah entalpi setiap pembentukan 1 mol senyawa dari unsur-unsur penyusunnya pada keadaan standar. Pada reaksi yang disajikan adalah ∆Ho pembentukan 2 mol MgCl2.
∆Hfo MgCl2 = ½ (–1283,6 kJ/mol) = –641,8 kJ/mol
Kunci Jawaban Soal KSN-K 2020 Kimia: C
Download Pembahasan Soal KSN-K Kimia 2020 PDF Tingkat Kabupaten/Kota Pilgan Nomor 1-15

Soal KSN-K 2020 Kimia Nomor 6
Berdasarkan data kalor pembentukan H2O(g) = –241,8 kJ/mol, kalor disosiasi H2(g) = +436 kJ/mol, dan kalor disosiasi O2(g) = +498 kJ/mol, maka energi ikatan O–H adalah …..
A. 221,6 kJ/mol
B. 443,2 kJ/mol
C. 463,4 kJ/mol
D. 587,9 kJ/mol
E. 926,8 kJ/mol
Pembahasan Soal KSN-K 2020 Kimia Nomor 6
Reaksi yang terjadi:
H2(g) + ½ O2(g) → H2O(g)
∆H = 436 kJ/mol + ½ (498 kJ/mol) – (–241,8 kJ/mol)
∆H = 436 kJ/mol + 249 kJ/mol) + 241,8 kJ/mol)
∆H = 926,8 kJ/mol
Dalam setiap molekul H2O atau H–O–H terdapat 2 ikatan O–H,
jadi energi ikatan O–H = 926,8 kJ/mol ÷ 2 = 463,4 kJ/mol
Kunci Jawaban Soal KSN-K 2020 Kimia: C
Soal KSN-K 2020 Kimia Nomor 7
Di antara serial bilangan kuantum berikut, yang menjelaskan orbital 4f adalah …..
A. n = 2, l = 0, ml = 0
B. n = 3, l = 1, ml = –1
C. n = 3, l = 2, ml = –1
D. n = 4, l = 2, ml = +1
E. n = 4, l = 3, ml = +2
Pembahasan Soal KSN-K 2020 Kimia Nomor 7
Orbital 4f memiliki bilangan kuntum utama n = 4; orbital f → l = 3. Bilangan kuantum azimuth l = 3 memberikan kemungkinan nilai bilangan kuantum magnetik mulai dari –3, –2, –1, 0, +1, +2, +3
Kunci Jawaban Soal KSN-K 2020 Kimia: E
Soal KSN-K 2020 Kimia Nomor 8
Di antara unsur berikut, yang dapat membentuk ion bermuatan +2 dengan konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 3d10 adalah ….
A. K
B. Si
C. Zn
D. Ca
E. Ge
Pembahasan Soal KSN-K 2020 Kimia Nomor 8
Konfigurasi elektron X2+ = 1s2 2s2 2p6 3s2 3p6 3d10 jumlah elektron = 28, ketika dalam keadaan dasar (netral, bukan ion, elektron dikembalikan dengan menambah 2) maka jumlah elektron menjadi 28+2 = 30. Unsur yang bernomor atom 30 adalah Zn.
Kunci Jawaban Soal KSN-K 2020 Kimia: C
Soal KSN-K 2020 Kimia Nomor 9
Di antara molekul atau ion berikut ini: SO3, CO2, NO2+, dan ClO2–, yang isoelektronik adalah ….
A. SO3 dan CO2
B. NO2+ dan ClO2–
C. CO2 dan NO2+
D. NO2+ dan SO3
E. CO2 dan ClO2–
Pembahasan Soal KSN-K 2020 Kimia Nomor 9
Spesi isoelektronik adalah spesi (boleh molekul atau ion) yang memiliki jumlah elektron sama. Jumlah elektron setiap atom = nomor atom, bila bermuatan positif jumlah elektronnya berkurang sebanyak muatan positif, bila bermuatan negatif jumlah elektronnya bertambah sebanyak muatan negatifnya. urip.info
Analisis jumlah elektron setiap spesi:
SO3 = 16 + (8×3) = 40 elektron
CO2 = 6 + (8×2) = 22 elektron
NO2+ = 7 + (8×2) – 1 = 22 elektron
ClO2– = 17 + (8×2) + 1 = 34 elektron
Kunci Jawaban Soal KSN-K 2020 Kimia: C
Soal KSN-K 2020 Kimia Nomor 10
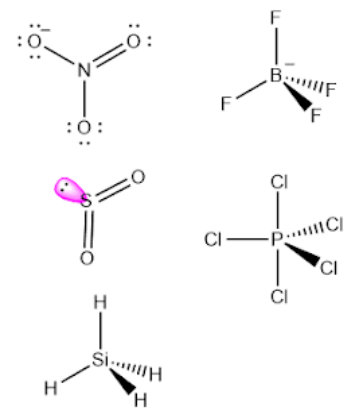
Berdasarkan geometri molekulnya, di antara ion atau molekul berikut yang mempunyai momen dipol paling besar adalah ….
A. NO3–
B. SO2
C. SiH4
D. BF4–
E. PCl5
Pembahasan Soal KSN-K 2020 Kimia Nomor 10
Momen dipol palingb esar ditandai dengan semakin tidak simetris suatu molekul atau ion.
Download Pembahasan Soal KSN-K Kimia 2020 PDF Tingkat Kabupaten/Kota Pilgan Nomor 1-15

Soal KSN-K 2020 Kimia Nomor 11
Urutan yang benar mengenai peningkatan ukuran radius ion Na+, Mg2+, dan Al3+ adalah ….
A. Na+ < Mg2+ < Al3+
B. Mg2+ < Al3+ < Na+
C. Al3+ < Na+ < Mg2+
D. Al3+ < Mg2+ < Na+
E. Na+ < Al3+ < Mg2+
Pembahasan Soal KSN-K 2020 Kimia Nomor 11
Umumnya jari-jari kation dari unsur seperiode dari kiri ke kanan semakin kecil. Na, Mg, Al adalah unsur seperiode dari kiri ke kanan. Dengan demikian urutan jari-jari ion Al3+ < Mg2+ < Na+
Kunci Jawaban Soal KSN-K 2020 Kimia: D
Soal KSN-K 2020 Kimia Nomor 12
Di antara senyawa ion berikut, yang mempunyai energi kisi paling kecil adalah ….
A. NaI
B. LiF
C. KBr
D. NaCl
E. CsI
Pembahasan Soal KSN-K 2020 Kimia Nomor 12
Semakin besar muatan ion-ion dan semakin kecil jari-jari ion maka menghasilkan energi kisi semakin besar, sebaliknya semakin kecil jumlah muatan ion-ion dan semakin besar jari-jari ion-ion menghasilkan energi kisi semakin kecil.
Dalam soal ini semuanya memiliki muatan yang sama yaitu +1 dan –1, dengan demikian yang menentukan energi kisi hanya jarak antarion, semakin besar jari-jari ion semakin kecil energi kisinya.
Jari-jari ion Cs+ terbesar, demikian pula jari-jari I– juga terbedar dibanding ion yang ada dalam perbandingan soal ini, maka CsI diperkirakan mempunyai energi kisi terkecil.
mMn+ (g) + nXm– (g) ⟶ MmXn (s) + Energi kisi.
E = k(Q1×Q2)/d
Q = jumlah muatan
d = jarak antarion.
Kunci Jawaban Soal KSN-K 2020 Kimia: E
Soal KSN-K 2020 Kimia Nomor 13
Jenis orbital hibrida atom C yang diberi tanda pada senyawa berikut ini adalah ….
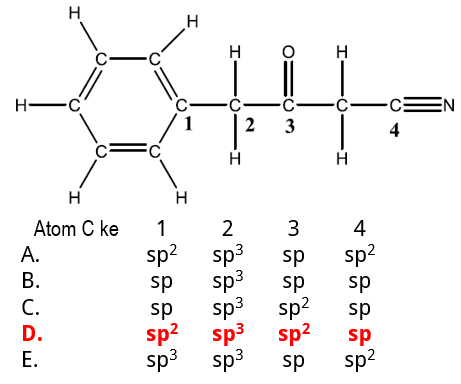
Pembahasan Soal KSN-K 2020 Kimia Nomor 13
Petunjuk yang mudah diingat mengenai orbital hibrida adalah jumlah ikatan sekitar atom, tanpa memedulikan apakah ikatan tunggal, ganda, atau tripel, semua dianggap satu domain.
2 domain ikatan → orbital hibrida sp (1s + 1p)
3 domain ikatan → orbital hibrida sp2 (1s + 2p)
4 domain ikatan → orbital hibrida sp3 (1s + 3p)
Atom C-1 → 3 ikatan = sp2
Atom C-2 → 4 ikatan = sp3
Atom C-3 → 3 ikatan = sp2
Atom C-4 → 2 ikatan = sp
Kunci Jawaban Soal KSN-K 2020 Kimia: D
Soal KSN-K 2020 Kimia Nomor 14
Pada 298 K, perubahan entalpi pembentukan standar dan perubahan entropi standar dari reaksi berikut : C(s) + ½O2(g) + 2H2(g) ⇌ CH3OH(g) berturut-turut adalah –205 kJ/mol dan 240 J/mol.K. Maka nilai ln Kp untuk reaksi tersebut adalah ….
A. 28,9
B. 53,9
C. 111,6
D. 133,5
E. 2931,6
Pembahasan Soal KSN-K 2020 Kimia Nomor 14
ΔG° = –RT ln Kp
ΔG° = ΔH° – TΔS°
–RT ln Kp = ΔH° – TΔS°
ln Kp = (ΔH° – TΔS°)/(–RT)
ln Kp = (–205.000 – (298 × 240))/(–8,314 × 298)
ln Kp = (–276.520)/(– 2477,572)
ln Kp = 111,6
Kunci Jawaban Soal KSN-K 2020 Kimia: C
Soal KSN-K 2020 Kimia Nomor 15
Perhatikanlah grafik energi reaksi hipotetis berikut : A + B → C + D,
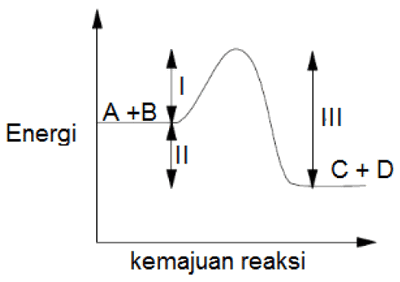
Nilai energi yang mengalami perubahan bila ditambahkan katalis adalah ….
A. Hanya I
B. Hanya II
C. I dan II
D. I dan III
E. I, II, dan III
Pembahasan Soal KSN-K 2020 Kimia Nomor 15
Penambahan katalis akan mengubah energi aktivasi menjadi lebih rendah. Dalam grafik energi aktivasi ditunjukkan pada nomor III. Bila III berubah maka tinggi maka tinggi I juga akan berubah, sementara itu tinggi II tidak mengalami perubahan.
Kunci Jawaban Soal KSN-K 2020 Kimia: D
Demikian tadi link download pembahasan soal KSN-K Kimia tahun 2020 PDF tingkat kabupaten/kota. Semoga bermanfaat untuk persiapan KSN-K 2021 2022 atau KSN-P 2010 tingkat provinsi.

Boleh mnt pembahasan soal osnk kimia 2020?