Pembahasan Soal UNBK Kimia Tahun 2018 Nomer 21 – 30

Soal UNBK Kimia 2018 Nomer 23
Seorang siswa ingin menentukan orde reaksi dari reaksi antara natrium tiosulfat dan asam klorida menghasilkan natrium klorida, air dan belerang dioksida dan endapan belerang menurut reaksi:
Na2S2O3(aq) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + SO2(g) + S(s)
Percobaan dilakukan dengan mengukur kecepatan terbentuknya endapan belerang. Data hasil percobaan disajikan pada tabel berikut ini.
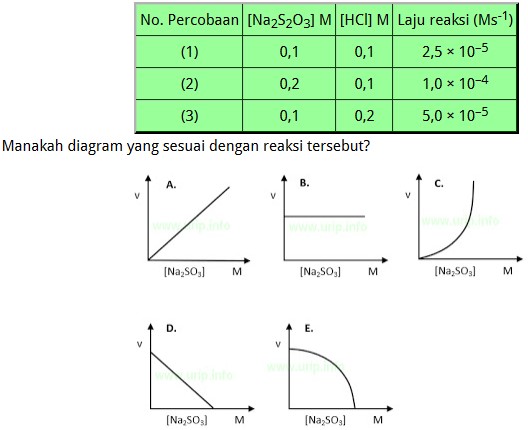
Pembahasan Soal UNBK Kimia 2018 Nomer 23
Kunci Jawaban Soal Kimia UNBK 2018 Nomer 23 : C
Untuk menentukan orde Na2SO3 kita menggunakan data nomor 2 dan 1 karena konsentrasi HCl tetap.
([Na2SO3]2/[ Na2SO3]1)x = v2/v1
(0,2/0,1)x = 1×10–4 / 2,5×10–5
2x = 4
2x = 22
x = 2
Grafik laju reaksi orde 2 yang benar adalah C
Soal UNBK Kimia 2018 Nomer 24
Respirasi aerob adalah peristiwa pemecahan glukosa dengan bantuan oksigen menghasilkan energi dalam bentuk ATP. Persamaan reaksi untuk pemecahan satu molekul glukosa secara sederhana adalah sebagai berikut.
C6H12O6(aq) + O2 (g) → CO2(g) + H2O(g) (belum setara)
Pada respirasi aerob terjadi pembakaran 5,4 g glukosa (Ar C = 12, H = 1, O = 16) dan gas oksigen yang tersedia adalah 6,4 g. Gas karbon dioksida yang dihasilkan pada peristiwa tersebut jika diukur pada keadaan STP adalah …
- 4,480 L
- 4,032 L
- 3,584 L
- 2,688 L
- 0,672 L
Pembahasan Soal UNBK Kimia 2018 Nomer 24
Kunci Jawaban Soal Kimia UNBK 2018 Nomer 24 : A
Volume gas-gas dalam reaksi akan sebanding dengan koefisien reaksi gas dalam persamaan reaksi yang setara. Pada keadaan STP setiap 1 mol gas = 22,4 L
Reaksi setara: C6H12O6(aq) + 6O2 (g) → 6CO2(g) + 6H2O(g)
Massa molar C6H12O6 = ((12×6)+(1×12)+(16×6)) g/mol = 180 g/mol
5,4 g C6H12O6 = 5,4 g : 180 g/mol = 0,03 mol
Massa molar O2 = 16×2 = 32 g/mol
6,4 g O2 = 6,4 g : 32 g/mol = 0,2 mol
Penentuan pereaksi pembatas, zat mana yang habis bereaksi yang akan digunkan sebagai pembanding untuk menentukan jumlah mol CO2.
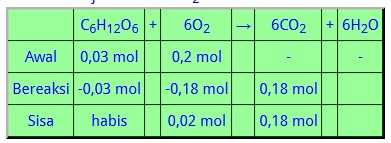
Jadi volume CO2 = 0,18 mol × 22,4 L/mol = 4,032 L
Soal UNBK Kimia 2018 Nomer 25
Tabel larutan penyangga beserta komposisinya.
| No. | Larutan Asam | Larutan Garam |
| (1) | 10 mL larutan HF 0,02 M | 10 mL larutan NaF 0,01 M |
| (2) | 10 mL larutan HF 0,04 M | 10 mL larutan KF 0,01 M |
| (3) | 10 mL larutan HF 0,06 M | 10 mL larutan NaF 0,01 M |
Diketahui Ka HF = 6,8×10–4 urutan harga pH mulai dari yang terkecil hingga ke terbesar adalah ….
- (1), (2), (3)
- (1), (3), (2)
- (2), (1), (3)
- (2), (3), (1)
- (3), (2), (1)
Pembahasan Soal UNBK Kimia 2018 Nomer 25
Kunci Jawaban Soal Kimia UNBK 2018 Nomer 25 : E
[H+] = Ka[asam lemah]/[basa konjugat]
Karena konsentrasi basa konjugat tetap, maka [H+] hanya ditentukan [asam lemah]. Semakin besar [asam lemah] maka [H+] semakin tinggi. pH = – log [H+], pH ini berbanding terbalik dengan [H+], semakin besar [H+] maka pH semakin kecil.
Jadi urutan yang benar adalah (3), (2), (1)

2 Komentar