Download Pembahasan Soal SBMPTN 2018 Kimia Nomer 32 Semua Kode Soal | Bentuk Molekul dan Kepolaran

Download Pembahasan Soal SBMPTN 2018 Kimia Nomer 32 Semua Kode Soal | Bentuk Molekul dan Kepolaran – Pelaksanaan SBMPTN 2019 sebentar lagi akan digelar. Berbagai persiapan dari murid-murid yang mengharapkan kampus negeri mulai dilakukan. Salah satunya adalah mencari soal dan pembahasan soal kimia SBMPTN 2018. Dalam beberapa tulisan ke depan kita fokus bahas soal SBMPTN Kimia 2018. Alhamdulillah pak urip.info sudah rilis pembahasan soal SBMPTN jadi bias menambah wawasan kita dalam persiapan masuk PTN tahun 2019.
Download Pembahasan Soal SBMPTN 2018 Kimia Nomer 32 Semua Kode Soal | Bentuk Molekul dan Kepolaran

Dalam tulisan kali ini, khusus untuk Soal SBMPTN Kimia Nomor 32 dengan pokok bahasan bentuk molekul dan kepolaran. Nomor sama berarti pokok bahasan sama namun bentuk soal berbeda.
Jumlah paket soal yang terkumpul sebanyak 23 kode berbeda. Namun, jika sahabat memiliki paket soal lain, silakan disampaikan untuk dibahas lebih lanjut. Jadi, tulisan-tulisan ini fokus satu topik bahasan.
Soal SBMPTN Kimia Nomor 32 – Kode 402, Kode 420, Kode 422, Kode 463, Kode 472
Nomor atom S dan F masing-masing adalah 16 dan 9. Kedua unsur tersebut dapat membentuk molekul SF4. Bentuk molekul dan kepolaran senyawa SF4 adalah ….
(A) tetrahedral dan nonpolar
(B) bipiramida segitiga dan polar
(C) planar segiempat dan nonpolar
(D) jungkat-jungkit dan polar
(E) piramida segiempat dan nonpolar
Pembahasan Soal SBMPTN Kimia Nomor 32 – Kode 402, Kode 420, Kode 422, Kode 463, Kode 472
Konfigurasi elektron unsur S 1s2 2s2 2p6 3s2 3p4
atau
Konfigurasi elektron Bohr (perkulit) unsur S = 2-8-6
Elektron valensi unsur S = 6
Konfigurasi elektron unsur F 1s2 2s2 2p5
atau
Konfigurasi elektron Bohr unsur F = 2-7.
Elektron valensi unsur F = 7
SF4 jumlah elektron valensi = ELEKTRON VALENSI S + (ELEKTRON VALENSI F × banyaknya F)
= 6 + (7×4)
= 6 + 28
= 34
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 34/8
Jumlah PEI = 4 dan sisa 2 elektron valensi
Angka penyebut 8 digunakan dengan perkiraan semua atom memenuhi aturan oktet.
Jumlah PEB = sisa elektron valensi : 2
Jumlah PEB = 2/2
Jumlah PEB = 1 PEB
SF4 → 4 PEI (X4) dan 1 PEB (E)
Jadi tipe molekul SF4 adalah AX4E dengan bentuk jungkat-jungkit.
Karena terdapat 1 PEB menyebabkan tarikan elektron menjadi tidak merata atau asimetris maka SF4 bersifat polar.

Jawaban pilihan ganda: D.
Soal SBMPTN Kimia Nomor 32 – Kode 403, Kode 429

Senyawa di atas yang bersifat polar adalah….
(A) 1, 2, 3, dan 4
(B) 1, 2, dan 3
(C) 1 dan 3
(D) 2 dan 4
(E) hanya 4
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 403, Kode 429
Mohon diperhatikan bahwa senyawa polar memiliki ciri khusus berupa memiliki pasangan elektron bebas atau PEB pada atom pusat dan strukturnya tidak simetris. Dari keempat struktur molekul yang memiliki PEB hanya NCl3 (molekul nomor 4).
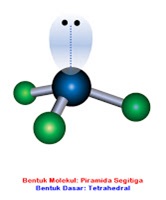
Jawaban pilihan ganda: D.
Soal SBMPTN Kimia Nomor 32 Kode 418, Kode 450, Kode 457, Kode 471
Unsur F (nomor atom = 9) dan M (nomor atom = 54) membentuk molekul MF4. Bentuk molekul dan sifat kepolaran molekul MF4 adalah ….
(A) tetrahedral dan nopolar
(B) planar segiempat dan nonpolar
(C) primida dan polar
(D) jungkat-jungkit dan polar
(E) bipiramida segitiga dan polar
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 418, Kode 457, Kode 471
Konfigurasi elektron unsur F: 1s2 2s2 2p5
atau
Konfigurasi elektron unsur Bohr = 2-7
Elektron valensi unsur F = 7
Konfigurasi elektron unsur M: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6.
atau
Konfigurasi elektron unsur Bohr = 2-8-18-18-8
Elektron valensi unsur M = 8
MF4 jumlah elektron valensi = elektron valensi M + (elektron valensi F × banyaknya F)
= 8 + (7×4)
= 8 + 28
= 36
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 36/8
Jumlah PEI = 4 dan sisa 4 elektron valensi
Angka penyebut 8 digunakan dengan perkiraan semua atom memenuhi aturan oktet.
Jumlah PEB = sisa elektron valensi : 2
Jumlah PEB = 4/2
Jumlah PEB = 2 PEB
MF4 → 4 PEI (X4) dan 2 PEB (E2)
Jadi tipe struktur MF4 adalah AX4E2 dengan bentuk bujur sangkar atau planar segiempat dan bersifat nonpolar karena posisi PEB berada pada posisi yang saling meniadakan kekuatan tarikan elektron.

Jawaban pilihan ganda: B.
Lanjut ke halaman selanjutnya

6 Komentar