
Download PDF DOC – Soal UN Nomer 27
Bacalah wacana berikut!
Kunci yang terbuat dari besi akan disepuh dengan logam emas menggunakan kuat arus 10 ampere selama 9650 detik, seperti gambar berikut.
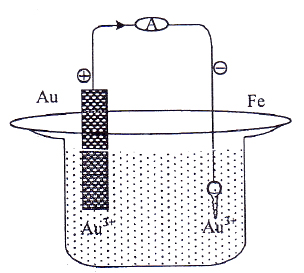
Pada reaksi penyepuhan kunci besi dengan logam emas diperlukan arus listrik 0,015 Faraday, massa logam emas yang melapisi kunci besi tersebut adalah …. (Ar Au = 197)
A. 0,0985 gram
B. 0,2985 gram
C. 0,9850 gram
D. 2,9850 gram
E. 9,8600 gram
Download PDF DOC – Pembahasan soal nomor 27
Kunci jawaban : C
Soal ini sebenarnya kelebihan data. Sayangnya data pertama (arus listrik dan waktu) memberikan hasil yang berbeda.
Au3+ + 3e–→ Ag
Massa ekivalen Au (e) = 197/3 = 65,67 g; t = 9650 detik; i = 10 ampere.
massa Au yang digunakan untuk melapisi kunci
m = (65,67 × 10 × 9.650)/96.500
m = 65,67 g → data tidak menghasilkan massa yang sama dengan data berikut.
massa Au yang digunakan untuk melapisi kunci
Massa ekivalen Au (e) = 197/3 = 65,67 g; F = 0,015 Faraday.
massa Au = e.F = 65,67 × 0,015 F = 0,985 g
Download PDF DOC – Soal UN Nomer 28
Perhatikan wacana berikut.
Senyawa aktif pada pemutih adalah senyawa natrium hipoklorit (NaClO). Untuk menghitung kadar NaClO dalam pemutih digunakan reaksi iodometri sebagai berikut.
NaClO(l) + 2KI(aq) + 2HCl(aq) → NaCl(aq) + 2KCl(aq) + I2(l) + H2O(l)
I2(l) + 2Na2S2O3(aq) → 2NaI(aq) + Na2S2O6(aq)
Berdasarkan wacana tersebut, untuk menghitung kadar NaClO dalam pemutih digunakan titrasi iodometri dengan Na2S2O3 sebagai larutan standar. Jika 20 mL NaClO dititrasi memerlukan 15 mL Na2S2O3 0,1 M, maka kadar NaClO (w/w) dalam pemutih tersebut adalah …. (Mr NaClO = 74,5, massa jenis NaClO = 1 g/mL).
A. 0,279%
B. 0,558%
C. 1,116%
D. 2,232%
E. 4,464%
Download PDF DOC – Pembahasan soal nomor 28
Kunci jawaban : A
Massa NaClO kotor:
Massa NaClO = Volume NaClO × massa jenis NaClO
Massa NaClO = 20 mL × 1 g/mL
Massa NaClO = 20 g
Hitungan dari titrasi:
Perbandingan koefisien antara NaClO dengan koefisien Na2S2O3 = 1 : 2.
Jumlah mol Na2S2O3 yang diperlukan = 15 mL × 0,1 M = 1,5 mmol
Jadi jumlah mol NaClO = ½ × 1,5 mmol = 0,75 mmol = 0,00075 mol
Massa NaClO = jumlah mol NaClO × massa molar NaClO
Massa NaClO = 0,00075 mol × 74,5 g/mol
Massa NaClO = 0,055875 g
Kadar NaClO = (massa NaClO titrasi : massa NaClO kotor) × 100%
Kadar NaClO = (0,055875 g : 20 g) × 100%
Kadar NaClO = 0,279%

11 Komentar